Bài 1.35* trang 8 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.35* trang 8 Sách bài tập (SBT) Hóa học 11 Nâng cao. 1. Viết biểu thức tính hằng số phân li bazơ của đimetylamin.
Đimetylamin \({(C{H_3})_2}NH + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) \({(C{H_3})_2}NH_2^ + + O{H^ - }\)
1. Viết biểu thức tính hằng số phân li bazơ \({K_b}\) của đimetylamin.
2. Tính pH của dung dịch đimetylamin 1,5M biết rằng \({K_b} = 5,{9.10^{ - 4}}\)
Giải :
\(1.\,{K_b} = {{\left[ {{{(C{H_3})}_2}NH_2^ + } \right].\left[ {O{H^ - }} \right]} \over {\left[ {{{(C{H_3})}_2}NH} \right]}}\)
2. Trong 1 lít dung dịch có 1,5 mol \({(C{H_3})_2}NH\). Giả sử x mol chất này có phản ứng với nước :
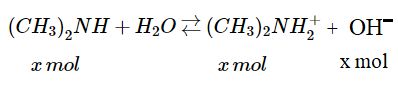
Vì \({K_b} = 5,{9.10^{ - 4}}\) lớn hơn rất nhiều so với tích số ion của nước \(({1.10^{ - 4}})\) nên có thể bỏ qua phần \(O{H^ - }\) sinh ra do sự điện li của nước.
Khi cân bằng, \(\left[ {{{(C{H_3})}_2}NH_2^ + } \right] = \left[ {O{H^ - }} \right] = x\)
Nồng độ đimetylamin \(\left[ {{{\left( {C{H_3}} \right)}_2}NH} \right] = (1,5 - x)\)
Vì \({K_b}\) nhỏ nên 1,5-x coi như bằng 1,5
\({K_b} = {{{x^2}} \over {1,5}} = 5,{9.10^{ - 4}};\)\(x = \sqrt {1,5.5,{{9.10}^{ - 4}}} \approx 3,{0.10^{ - 2}}(mol).\)
Nồng độ \(O{H^ - }\) là \(3,{0.10^{ - 2}}\) do đó nồng độ \( {H^ + }\) là
\(\left[ {{H^ + }} \right] = {{1,{{0.10}^{ - 14}}} \over {3,{{0.10}^{ - 2}}}} \approx 3,{3.10^{ - 13}}(mol/l)\)
pH của dung dịch điêmtylamin 1,5M là \(pH = - \lg \left[ {{H^ + }} \right] = 12,48\) .
Sachbaitap.com
Bài viết liên quan
Các bài khác cùng chuyên mục
- Bài 9.43 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.42 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.41 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.40 trang 76 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.39* trang 76 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 62. Luyện tập : Axit cacboxylic
- Bài 61. Axit cacboxylic : Tính chất hóa học, điều chế và ứng dụng
- Bài 60. Axit cacboxylic : cấu trúc, danh pháp và tính chất vật lí
- Bài 59. Luyện tập : Anđehit và xeton
- Bài 58. Anđehit và xeton
- CHƯƠNG 9 : ANDEHIT-XETON-AXIT CACBOXYLIC
- Bài 56. Luyện tập : Ancol, phenol
- Bài 55. Phenol
- Bài 54. Ancol : Tính chất hóa học, ứng dụng và điều chế
- Bài 53. Ancol : Cấu tạo, danh pháp và tính chất vật lí
- Bài 22 Đọc mở rộng trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Luyện viết đoạn văn thể hiện tình cảm, cảm xúc về một sự việc trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Bộ đội về làng trang 109 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 2) trang 108 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Luyện tập về câu ghép trang 107 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Anh hùng lao động Trần Đại Nghĩa trang 106 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đền ơn đáp nghĩa trang 104 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đánh giá, chỉnh sửa đoạn văn nêu ý kiến tán thành một sự vật, hiện tượng trang 103 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Cụ Đồ Chiểu trang 101 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 19 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 1) trang 100 SGK Tiếng Việt 5 Kết nối tri thức tập 2
 Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
