Giải SBT KHTN 7 Kết nối tri thức bài 6 trang 23, 24, 25
Giải bài 6 giới thiệu về liên kết hóa học trang 23, 24, 25 sách bài tập (SBT) Khoa học tự nhiên lớp 7 Kết nối tri thức. Bài 6.9. Hãy vẽ sơ đồ hình thành liên kết ion trong các phân tử sau, sử dụng các dấu chấm để biểu diễn các electron (tương tự hình 6.2 trang 37 SGK):
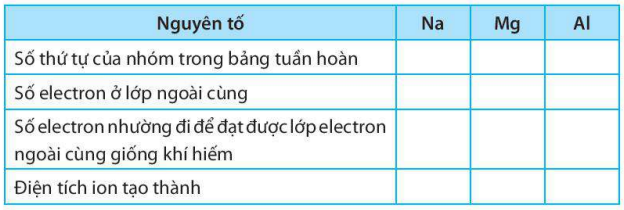
Bài 6.1 trang 23 SBT KHTN lớp 7 - Kết nối tri thức
a) Điền các thông tin còn thiếu để hoàn thành bảng sau về các kim loại.
b) Hãy nhận xét về số thứ tự của nhóm trong bảng tuần hoàn và điện tích của các ion kim loại tạo thành.
Lời giải:
a)
b) Số thứ tự của nhóm trong bảng tuần hoàn bằng số đơn vị điện tích của các ion kim loại tạo thành.
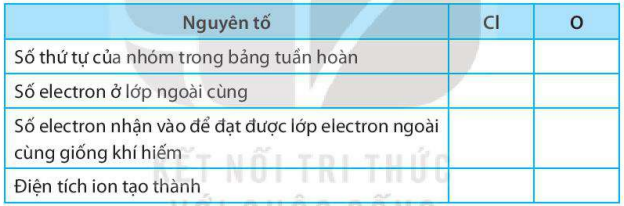
Bài 6.2 trang 23 SBT KHTN lớp 7 - Kết nối tri thức
a) Điền các thông tin còn thiếu để hoàn thành bảng sau về các phi kim.
b) Hãy nhận xét về mối quan hệ giữa số thứ tự của nhóm trong bảng tuần hoàn và điện tích của các ion phi kim tạo thành.
Lời giải:
a)
b) Số thứ tự của nhóm trong bảng tuần hoàn bằng 8 trừ đi số đơn vị điện tích của các ion phi kim tạo thành.
Bài 6.3 trang 23 SBT KHTN lớp 7 - Kết nối tri thức
a) Liên kết cộng hóa trị là gì?
b) Liên kết cộng hóa trị khác với liên kết ion như thế nào?
c) Liên kết cộng hóa trị và liên kết ion có điểm gì tương tự nhau?
Lời giải:
a) Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Mỗi cặp electron dùng chung tạo nên một liên kết cộng hóa trị.
c) Liên kết cộng hóa trị và liên kết ion đều là liên kết hóa học, các nguyên tử sau khi hình thành liên kết thì bền hơn trước khi hình thành liên kết.
Bài 6.4 trang 23 SBT KHTN lớp 7 - Kết nối tri thức
Phân tử methane gồm một nguyên tử carbon liên kết với bốn nguyên tử hydrogen. Khi hình thành liên kết cộng hóa trị trong methane, nguyên tử carbon góp chung bao nhiêu electron với mỗi nguyên tử hydrogen?
A. Nguyên tử carbon góp chung 1 electron với mỗi nguyên tử hydrogen.
B. Nguyên tử carbon góp chung 2 electron với mỗi nguyên tử hydrogen.
C. Nguyên tử carbon góp chung 3 electron với mỗi nguyên tử hydrogen.
D. Nguyên tử carbon góp chung 4 electron với mỗi nguyên tử hydrogen.
Lời giải:
Đáp án đúng là: A
Khi hình thành liên kết cộng hóa trị trong m
Bài 6.5 trang 24 SBT KHTN lớp 7 - Kết nối tri thức
Liên kết giữa các nguyên tử trong phân tử nước là liên kết
A. cộng hóa trị.
B. ion.
C. kim loại.
D. phi kim.
Phương pháp:
- Liên kết cộng hóa trị thường gặp nhiều trong các đơn chất phi kim, phân tử nước, ammonia (hợp chất được hình thành giữa các phi kim),... Các phân tử chỉ chứa liên kết cộng hóa trị được gọi là chất cộng hóa trị.
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Mỗi cặp electron dùng chung tạo nên một liên kết cộng hóa trị.
Lời giải:
Đáp án đúng là: A
Liên kết giữa các nguyên tử trong phân tử nước là liên kết cộng hóa trị.
Bài 6.6 trang 24 SBT KHTN lớp 7 - Kết nối tri thức
Liên kết hóa học giữa các nguyên tử oxygen và hydrogen trong phân tử nước được hình thành bằng cách
A. nguyên tử oxygen nhận electron, nguyên tử hydrogen nhường electron.
B. nguyên tử oxygen nhường electron, nguyên tử hydrogen nhận electron.
C. nguyên tử oxygen và nguyên tử hydrogen góp chung electron.
D. nguyên tử oxygen và nguyên tử hydrogen góp chung proton.
Phương pháp:
- Liên kết cộng hóa trị thường gặp nhiều trong các đơn chất phi kim, phân tử nước, ammonia (hợp chất được hình thành giữa các phi kim),... Các phân tử chỉ chứa liên kết cộng hóa trị được gọi là chất cộng hóa trị.
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Mỗi cặp electron dùng chung tạo nên một liên kết cộng hóa trị.
Lời giải:
Đáp án đúng là: C
Liên kết hóa học giữa các nguyên tử oxygen và hydrogen được hình thành bằng cách nguyên tử oxygen và nguyên tử hydrogen góp chung electron.
Bài 6.7 trang 24 SBT KHTN lớp 7 - Kết nối tri thức
Trong phân tử oxygen (O2), khi hai nguyên tử oxygen liên kết với nhau, chúng
A. góp chung proton.
B. chuyển electron từ nguyên tử này sang nguyên tử kia.
C. chuyển proton từ nguyên tử này sang nguyên tử kia.
D. góp chung electron.
Phương pháp:
- Liên kết cộng hóa trị thường gặp nhiều trong các đơn chất phi kim, phân tử nước, ammonia (hợp chất được hình thành giữa các phi kim),... Các phân tử chỉ chứa liên kết cộng hóa trị được gọi là chất cộng hóa trị.
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Mỗi cặp electron dùng chung tạo nên một liên kết cộng hóa trị.
Lời giải:
Đáp án đúng là: D
Trong phân tử oxygen (O2), khi hai nguyên tử oxygen liên kết với nhau, chúng góp chung electron.
Bài 6.8 trang 24 SBT KHTN lớp 7 - Kết nối tri thức
Trong phân tử KCl, nguyên tử K (potassium) và nguyên tử Cl (chlorine) liên kết với nhau bằng liên kết
A. cộng hóa trị.
B. ion.
C. kim loại.
D. phi kim.
Phương pháp:
- Liên kết ion được hình thành giữa các nguyên tử kim loại và nguyên tử phi kim, nguyên tử kim loại nhường electron, trở thành ion dương, nguyên tử phi kim nhận electron từ kim loại, trở thành ion âm. Các ion trái dấu hút nhau tạo thành liên kết trong hợp chất ion.
⇨ Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
Hợp chất ion khó bay hơi, khó nóng chảy, là chất rắn ở điều kiện thường, khi tan trong nước tạo thành dung dịch dẫn điện.
Lời giải:
Đáp án đúng là: B
Trong phân tử KCl, nguyên tử K (kali) và nguyên tử Cl (chlorine) liên kết với nhau bằng liên kết ion.
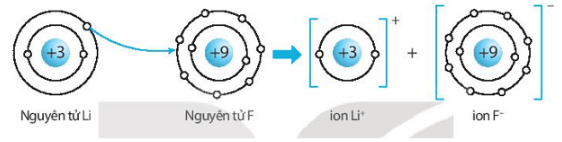
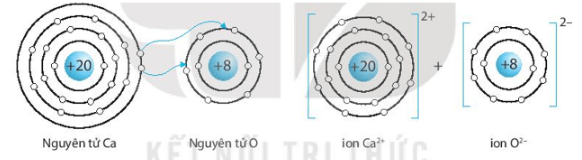
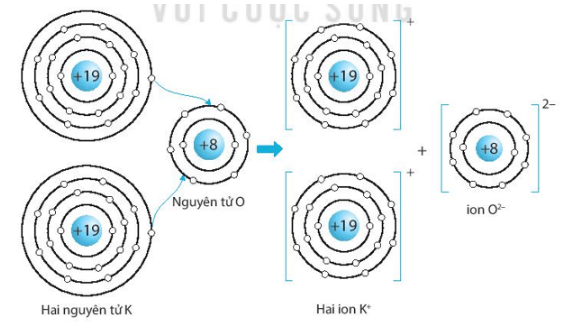
Bài 6.9 trang 24 SBT KHTN lớp 7 - Kết nối tri thức
Hãy vẽ sơ đồ hình thành liên kết ion trong các phân tử sau, sử dụng các dấu chấm để biểu diễn các electron (tương tự hình 6.2 trang 37 SGK):
a) Lithium fluoride (LiF).
b) Calcium oxide (CaO).
c) Potassium oxide (K2O).
Lời giải:
a) Sơ đồ tạo thành liên kết ion trong phân tử lithium fluoride (LiF):
b) Sơ đồ tạo thành liên kết ion trong phân tử calcium oxide (CaO):
c) Sơ đồ tạo thành liên kết ion trong phân tử potassium oxide (K2O):
Bài 6.10 trang 25 SBT KHTN lớp 7 - Kết nối tri thức
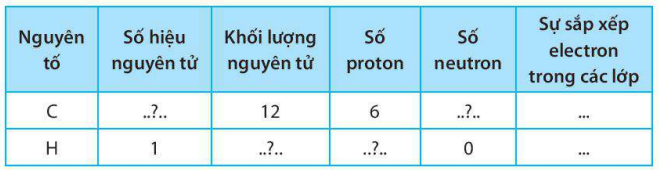
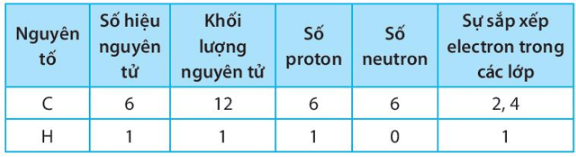
Điền các số thích hợp vào các ô còn trống để hoàn thành bảng sau
Phương pháp:
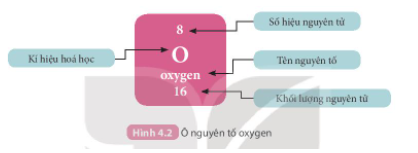
- Ô nguyên tố cho biết: kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử và khối lượng nguyên tử của nguyên tố đó.
- Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron trong nguyên tử.
- Số hiệu nguyên tử là số thứ tự của nguyên tố trong bảng tuần hoàn.
- Khối lượng nguyên tử (amu) = Số proton x 1 + Số neutron x 1
⇨ Số neutron = Khối lượng nguyên tử - Số proton
- Sự phân bố của các electron trên các lớp electron:
+ Lớp electron gần hạt nhân nhất (lớp thứ nhất) có 2 electron.
+ Lớp electron thứ 2 chứa tối đa 8 electron.
+ Lớp electron thứ 3 chứa 8 electron, tối đa 18 electron.
Lời giải:
Bài 6.11 trang 25 SBT KHTN lớp 7 - Kết nối tri thức
Hãy vẽ sơ đồ biểu diễn sự hình thành liên kết cộng hóa trị trong các phân tử sau, sử dụng các dấu chấm để biểu diễn các electron (tương tự như hình 6.5 trang 38 SGK):
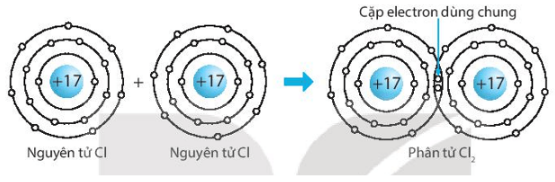
a) Chlorine (Cl2).
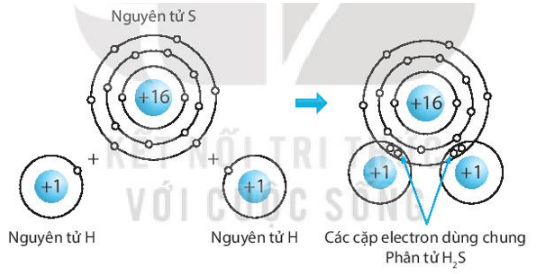
b) Hydrogen sulfide (H2S).
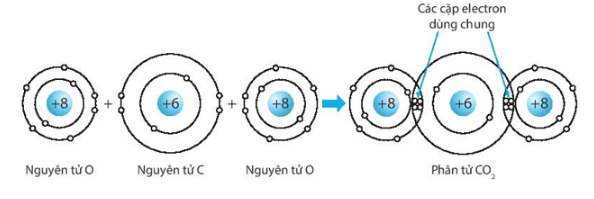
c) Carbon dioxide (CO2).
Lời giải:
a) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử chlorine, Cl2:
b) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử hydrogen sulphide, H2S:
c) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, CO2:
Bài 6.12 trang 25 SBT KHTN lớp 7 - Kết nối tri thức
Hãy giải thích các câu sau dựa trên tính chất của liên kết (ion hay cộng hóa trị) giữa các nguyên tử trong các phân tử các chất.
a) Vì sao ammonia là chất khí ở nhiệt độ phòng.
b) Vì sao nhiệt độ nóng chảy của sodium chloride và iodine rất khác nhau? Nhiệt độ nóng chảy của chất nào cao hơn?
Lời giải:
a) Ammonia là hợp chất cộng hóa trị (liên kết giữa các nguyên tử N và H trong NH3 là liên kết cộng hóa trị), có nhiệt độ sôi thấp nên là chất khí ở nhiệt độ phòng.
Đơn chất magnesium và đơn chất chlorine phản ứng với nhau tạo thành hợp chất magnesium chloride, là hợp chất có cấu trúc tinh thể.
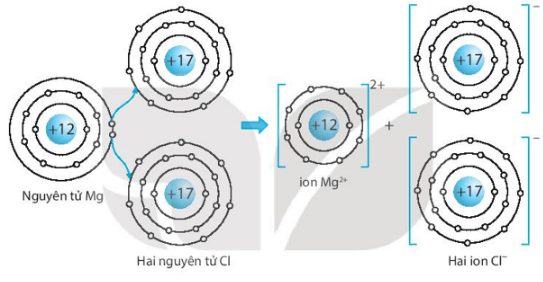
a) Vẽ sơ đồ mô tả sự hình thành liên kết ion trong hợp chất MgCl2 từ các nguyên tử Mg và Cl (xem hình 6.2, trang 37 SGK). Cho biết số proton trong hạt nhân của Mg là 12 và của Cl là 17.
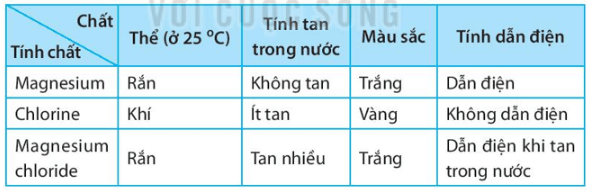
b) Lập bảng mô tả một số tính chất của đơn chất magnesium, đơn chất chlorine và hợp chất magnesium chloride. Các tính chất bao gồm:
(i) thể của chất ở nhiệt độ phòng (25 oC)
(ii) tính tan trong nước (hoặc phản ứng với nước).
(iii) màu sắc.
(iv) tính dẫn điện.
Lời giải:
a) Sơ đồ mô tả sự hình thành liên kết ion trong hợp chất MgCl2 từ các nguyên tử Mg và Cl:
b) Bảng mô tả một số tính chất của đơn chất magnesium, đơn chất chlorine và hợp chất magnesium chloride:
Bài viết liên quan
Các bài khác cùng chuyên mục
- Giải SBT KHTN 7 Kết nối tri thức bài 24 trang 57, 58, 59 (15/12)
- Giải SBT KHTN 7 Kết nối tri thức bài 23 trang 56, 57 (15/12)
- Giải SBT KHTN 7 Kết nối tri thức bài 22 trang 54, 55 (15/12)
- Giải SBT KHTN 7 Kết nối tri thức bài 21 trang 53, 54 (15/12)
- Giải SBT KHTN 7 Kết nối tri thức bài 20 trang 51, 52 (10/12)
- Bài 24. Thực hành: Chứng minh quang hợp ở cây xanh
- Bài 23. Một số yếu tố ảnh hưởng đến quang hợp
- Bài 22. Quang hợp ở thực vật
- Bài 21. Khái quát về trao đổi chất và chuyển hóa năng lượng
- Chương VII. Trao đổi chất và chuyển hóa năng lượng sinh vật
- Bài 20. Chế tạo nam châm điện đơn giản
- Bài 19. Từ trường
- Bài 18. Nam châm
- Chương VI. Từ
- Bài 17. Ảnh của vật qua gương phẳng
- Bài 22 Đọc mở rộng trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Luyện viết đoạn văn thể hiện tình cảm, cảm xúc về một sự việc trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Bộ đội về làng trang 109 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 2) trang 108 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Luyện tập về câu ghép trang 107 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Anh hùng lao động Trần Đại Nghĩa trang 106 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đền ơn đáp nghĩa trang 104 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đánh giá, chỉnh sửa đoạn văn nêu ý kiến tán thành một sự vật, hiện tượng trang 103 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Cụ Đồ Chiểu trang 101 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 19 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 1) trang 100 SGK Tiếng Việt 5 Kết nối tri thức tập 2
 Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!