Bài 1.42 trang 10 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.42 trang 10 Sách bài tập (SBT) Hóa học 11 Nâng cao. Trộn 250 ml dung dịch hỗn hợp HCl 0,08 mol/l và 0,01 mol/l với 250 ml dung dịch có nồng độ x mol/l thu được m gam kết tủa và 500 ml dung dịch có pH=12.
Trộn 250 ml dung dịch hỗn hợp HCl 0,08 mol/l và \({H_2}S{O_4}\) 0,01 mol/l với 250 ml dung dịch \(Ba{(OH)_2}\) có nồng độ x mol/l thu được m gam kết tủa và 500 ml dung dịch có pH=12. Hãy tính m và x. Coi \(Ba{(OH)_2}\) điện li hoàn toàn cả hai nấc.
Giải :
Số mol HCl ban đầu :\({{0,08.250} \over {1000}} = 0,02(mol)\)
Số mol \({H_2}S{O_4}\) ban đầu : \({{0,01.250} \over {1000}} = 0,0025(mol)\)
Sau phản ứng có dung dịch pH=12 nghĩa \(Ba{(OH)_2}\) còn dư và các axit đã phản ứng hết.
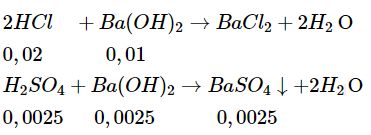
Khối lượng kết tủa : m = 0,0025.233 = 0,5825(g).
Sau phản ứng, dung dịch có pH=12 nghĩa là:
\(\left[ {{H^ + }} \right] = {10^{ - 12}}\left( {mol/l} \right)\)
\( \to \left[ {O{H^ - }} \right] = {10^{ - 2}}\left( {mol/l} \right) = 0,01\) \(\left( {mol/l} \right)\)
Số mol \(OH^-\) trong dung dịch:
\({{0,01.500} \over {1000}} = 0,005\left( {mol} \right)\)
\(Ba{\left( {OH} \right)_2} \to B{a^{2 + }} + 2O{H^ - }\)
Số mol \(Ba(OH)_2\) còn dư \(= {1 \over 2}{n_{O{H^ - }}} = 0,0025\left( {mol} \right)\)
Số mol \(Ba(OH)_2\) ban đầu là: \(0,01+0,0025+0,0025 =0.015\) (mol)
Nồng độ \(Ba(OH)_2\) là: \(x = {{0,015} \over {0,25}} = 0,06\) (mol/l)
Sachbaitap.com
Bài viết liên quan
Các bài khác cùng chuyên mục
- Bài 9.43 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.42 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.41 trang 77 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.40 trang 76 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 9.39* trang 76 Sách bài tập (SBT) Hóa học 11 Nâng cao (20/08)
- Bài 62. Luyện tập : Axit cacboxylic
- Bài 61. Axit cacboxylic : Tính chất hóa học, điều chế và ứng dụng
- Bài 60. Axit cacboxylic : cấu trúc, danh pháp và tính chất vật lí
- Bài 59. Luyện tập : Anđehit và xeton
- Bài 58. Anđehit và xeton
- CHƯƠNG 9 : ANDEHIT-XETON-AXIT CACBOXYLIC
- Bài 56. Luyện tập : Ancol, phenol
- Bài 55. Phenol
- Bài 54. Ancol : Tính chất hóa học, ứng dụng và điều chế
- Bài 53. Ancol : Cấu tạo, danh pháp và tính chất vật lí
- Bài 22 Đọc mở rộng trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Luyện viết đoạn văn thể hiện tình cảm, cảm xúc về một sự việc trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Bộ đội về làng trang 109 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 2) trang 108 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Luyện tập về câu ghép trang 107 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Anh hùng lao động Trần Đại Nghĩa trang 106 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đền ơn đáp nghĩa trang 104 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đánh giá, chỉnh sửa đoạn văn nêu ý kiến tán thành một sự vật, hiện tượng trang 103 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Cụ Đồ Chiểu trang 101 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 19 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 1) trang 100 SGK Tiếng Việt 5 Kết nối tri thức tập 2
 Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
