Bài 7.30 trang 71 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 7.30 trang 71 Sách bài tập (SBT) Hóa học 10 Nâng cao. Hỏi khi cân bằng mới được thiết lập, số mol mỗi chất trong hỗn hợp là bao nhiêu?
Bài 7.30 trang 71 SBT Hóa Học 10 Nâng cao
Axit axetic tác dụng với ancol isopropylic theo phản ứng thuận nghịch:
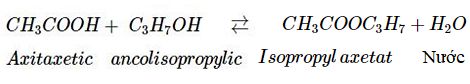
Nếu ban đầu người ta cho 1 mol axit axetic tác dụng với 1 mol ancol isopropylic thì cân bằng sẽ đạt được khi có 0,6 mol isopropyl axetat được tạo thành.
Lúc đó người ta thêm 1 mol axit axetic vào hỗn hợp phản ứng, cân bằng sẽ bị phá vỡ và chuyển dịch đến trạng thái cân bằng mới.
Hỏi khi cân bằng mới được thiết lập, số mol mỗi chất trong hỗn hợp là bao nhiêu?
Giải
Để tạo r a 0,6 mol isopropylic axetat cần tiêu hao 0,6 mol axit axetic, 0,6 mol ancol isopropylic. Lượng nước tao ra cũng là 0,6 mol. Khi cân bằng lần thứ nhất được thiết lập, nồng độ mol các chất trong hỗn hợp như sau:
\(\left[ {C{H_3}{\rm{COO}}{{\rm{C}}_3}{H_7}} \right] = {{0,6} \over V}\,\left( {mol/l} \right)\) \(\left[ {{H_2}O} \right] = {{0,6} \over V}\,\left( {mol/l} \right)\)
\(\left[ {C{H_3}{\rm{COOH}}} \right] = {{0,4} \over V}\,\,\left( {mol/l} \right)\) \(\left[ {{C_3}{H_7}OH} \right] = {{0,4} \over V}\,\,\left( {mol/l} \right)\)
(V là thể tích của hỗn hợp phản ứng)
Hằng số cân bằng:
\(K = {{\left[ {C{H_3}{\rm{COO}}{{\rm{C}}_3}{H_7}} \right].\left[ {{H_2}O} \right]} \over {\left[ {C{H_3}COOH} \right].\left[ {{C_3}{H_7}OH} \right]}} = {{0,36} \over {0,16}} \)\(= 2,25\)
Khi thêm 1 mol axit axetic vào hỗn hợp đang cân bằng thì cân bằng sẽ chuyển dịch.
\(C{H_3}COOH\,\,\,\, + \,\,\,{C_3}{H_7}OH\,\,\,\,\, \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}}\)\( \,\,\,\,\,C{H_3}COO{C_3}{H_7}\,\,\,\, + \,\,\,\,{H_2}O\)
|
Lúc bắt đầu thêm axit |
1,4 mol |
0,4 mol |
0,6 mol |
0,6 mol |
|
Biến đổi |
- x mol |
- x mol |
+ x mol |
+ x mol |
|
Lúc có cân bằng mới |
(1,4 – x) mol |
(0,4 – x) mol |
(0,6 + x) mol |
(0,6 + x) mol |
Khi cân bằng mới được thiết lập lại, nồng độ mol các chất như sau:
\(\left[ {C{H_3}COO{C_3}{H_7}} \right] = {{0,6 + x} \over {V'}}\) \(\left[ {{H_2}O} \right] = {{0,6 + x} \over {V'}}\)
\(\left[ {C{H_3}COOH} \right] = {{1,4 - x} \over {V'}}\) \(\left[ {{C_3}{H_7}OH} \right] = {{0,4 - x} \over {V'}}\)
(V’ là thể tích của hỗn hợp phản ứng lúc đó).
Hằng số cân bằng của phản ứng vẫn là 2,25 nên ta có:
\(\eqalign{
& {{{{\left( {0,6 + x} \right)}^2}} \over {\left( {1,4 - x} \right)\left( {0,4 - x} \right)}} = 2,25\,\, \cr
& \buildrel {\,\,} \over
\longrightarrow \,\,1,25{x^2} - 525x + 0,9 = 0 \cr} \)
Phương trình này có hai nghiệm: \({x_1} = 4,02\) và \({x_2} = 0,18\)
Chỉ có nghiệm x = 0,18 là thích hợp vì 1,4 - 4,02 < 0 là vô lí. Vậy khi cân bằng được thiết lập trở lại, hỗn hợp phản ứng có:
1,4 – 0,18 = 1,22 (mol CH3COOH);
0,4 – 0,18 = 0,22 (mol C3H7OH);
0,6 + 0,18 = 0,78 (mol CH3COOC3H7) và 0,78 mol H2O.
Sachbaitap.com
Bài viết liên quan
Các bài khác cùng chuyên mục
- Bài 7.30 trang 71 Sách bài tập (SBT) Hóa học 10 Nâng cao (08/08)
- Bài 7.29 trang 71 Sách bài tập (SBT) Hóa học 10 Nâng cao (08/08)
- Bài 7.28 trang 71 Sách bài tập (SBT) Hóa học 10 Nâng cao (08/08)
- Bài 7.27 trang 70 Sách bài tập (SBT) Hóa học 10 Nâng cao (08/08)
- Bài 7.26 trang 70 Sách bài tập (SBT) Hóa học 10 Nâng cao (08/08)
- Bài 51: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Bài 50: Cân bằng hóa học
- Bài 49: Tốc độ phản ứng hóa học
- CHƯƠNG 7. TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC - SBT HÓA 10 NÂNG CAO
- Bài 46: Luyện tập chương 6
- Bài 45: Hợp chất có oxi của lưu huỳnh
- Bài 44: Hiđro sunfua
- Bài 43: Lưu huỳnh
- Bài 42: Ozon và hiđro peoxit
- Bài 41: Oxi
- Bài 22 Đọc mở rộng trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Luyện viết đoạn văn thể hiện tình cảm, cảm xúc về một sự việc trang 111 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 22 Bộ đội về làng trang 109 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 2) trang 108 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Luyện tập về câu ghép trang 107 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 21 Anh hùng lao động Trần Đại Nghĩa trang 106 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đền ơn đáp nghĩa trang 104 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Đánh giá, chỉnh sửa đoạn văn nêu ý kiến tán thành một sự vật, hiện tượng trang 103 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 20 Cụ Đồ Chiểu trang 101 SGK Tiếng Việt 5 Kết nối tri thức tập 2
- Bài 19 Viết đoạn văn nêu ý kiến tán thành một sự việc, hiện tượng (Bài viết số 1) trang 100 SGK Tiếng Việt 5 Kết nối tri thức tập 2
 Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!
Tải app loigiaihay.com cho Android để lưu và xem mà không cần mạng!